
Dari tiga macam sistem dispersi tersebut, tunjukkan manakah larutan, koloid, dan suspensi??
Apa yang menyebabkan koloid memiliki sifat yang berbeda dari larutan dan suspensi??
------------------------------------------------------------------------------------------------
a. Efek Tyndall
Efek Tyndall ialah gejala penghamburan berkas sinar (cahaya) oleh partikel-partikel koloid. Hal ini disebabkan karena ukuran molekul koloid yang cukup besar. Efek tyndall ini ditemukan oleh John Tyndall (1820-1893), seorang ahli fisika Inggris. Oleh karena itu sifat itu disebut efek tyndall. Animasi efek tyndall https://www.youtube.com/watch?v=NaURE8gTXqk
Efek Tyndall ialah gejala penghamburan berkas sinar (cahaya) oleh partikel-partikel koloid. Hal ini disebabkan karena ukuran molekul koloid yang cukup besar. Efek tyndall ini ditemukan oleh John Tyndall (1820-1893), seorang ahli fisika Inggris. Oleh karena itu sifat itu disebut efek tyndall. Animasi efek tyndall https://www.youtube.com/watch?v=NaURE8gTXqk
 |
| Perbedaan larutan & kolid pada saat terkena cahaya |
Efek tyndall adalah efek yang terjadi jika suatu larutan
terkena sinar. Pada saat larutan sejati (gambar kiri) disinari dengan cahaya, maka larutan tersebut tidak
akan menghamburkan cahaya, sedangkan pada sistem koloid (gambar kanan), cahaya
akan dihamburkan. hal itu terjadi karena partikel-partikel koloid mempunyai
partikel-partikel yang relatif besar untuk dapat menghamburkan sinar tersebut.
Sebaliknya, pada larutan sejati, partikel-partikelnya relatif kecil sehingga
hamburan yang terjadi hanya sedikit dan sangat sulit diamati.
b. Gerak Brown
Gerak Brown ialah gerakan partikel-partikel koloid yang senantiasa bergerak lurus tapi tidak menentu (gerak acak/tidak beraturan). Gerakan tersebut dapat bersifat acak seperti pada zat cair dan gas, atau hanya bervibrasi di tempat seperti pada zat padat. Untuk koloid dengan medium pendispersi zat cair atau gas, pergerakan partikel-partikel akan menghasilkan tumbukan dengan partikel-partikel koloid itu sendiri. ukuran partikel koloid dan semakin cepat kecepatan gerak partikel, semakin cepat gerak Brown terjadi.
Gerak Brown ialah gerakan partikel-partikel koloid yang senantiasa bergerak lurus tapi tidak menentu (gerak acak/tidak beraturan). Gerakan tersebut dapat bersifat acak seperti pada zat cair dan gas, atau hanya bervibrasi di tempat seperti pada zat padat. Untuk koloid dengan medium pendispersi zat cair atau gas, pergerakan partikel-partikel akan menghasilkan tumbukan dengan partikel-partikel koloid itu sendiri. ukuran partikel koloid dan semakin cepat kecepatan gerak partikel, semakin cepat gerak Brown terjadi.
 |
| Gerak Brown |
Tumbukan tersebut berlangsung dari segala
arah. Oleh karena ukuran partikel cukup kecil, maka tumbukan yang terjadi
cenderung tidak seimbang. Sehingga terdapat suatu resultan tumbukan yang
menyebabkan perubahan arah gerak partikel sehingga terjadi gerak zigzag atau
gerak Brown. Animasi gerak Brown https://www.youtube.com/watch?v=gznbl9PtUd4
c. Adsorpsi
 Adsorpsi adalah peristiwa di mana suatu zat menempel pada permukaan zat lain, seperti ion H+ dan OH– dari
medium pendispersi. Untuk berlangsungnya adsorpsi, minimum harus ada
dua macam zat, yaitu zat yang tertarik disebut adsorbat, dan zat yang
menarik disebut adsorban. Apabila terjadi penyerapan ion ada permukaan
partikel koloid maka partikel koloid dapat bermuatan listrik yang
muatannya ditentukan oleh muatan ion-ion yang mengelilinginya.
Adsorpsi adalah peristiwa di mana suatu zat menempel pada permukaan zat lain, seperti ion H+ dan OH– dari
medium pendispersi. Untuk berlangsungnya adsorpsi, minimum harus ada
dua macam zat, yaitu zat yang tertarik disebut adsorbat, dan zat yang
menarik disebut adsorban. Apabila terjadi penyerapan ion ada permukaan
partikel koloid maka partikel koloid dapat bermuatan listrik yang
muatannya ditentukan oleh muatan ion-ion yang mengelilinginya. Partikel
koloid mempunyai kemampuan menyerap ion atau muatan listrik pada
permukaannya. Oleh karena itu partikel koloid bermuatan listrik.
Penyerapan pada permukaan ini disebut dengan adsorpsi. Contohnya sol
Fe(OH)3 dalam air mengadsorpsi ion positif sehingga bermuatan positif dan sol As2S3
mengadsorpsi ion negatif sehingga bermuatan negatif. Pemanfaatan sifat
adsorpsi koloid dalam kehidupan antara lain dalam proses pemutihan gula
tebu, dalam pembuatan norit (tablet yang terbuat dari karbon aktif) dan
dalam proses penjernihan air dengan penambahan tawas.
Partikel
koloid mempunyai kemampuan menyerap ion atau muatan listrik pada
permukaannya. Oleh karena itu partikel koloid bermuatan listrik.
Penyerapan pada permukaan ini disebut dengan adsorpsi. Contohnya sol
Fe(OH)3 dalam air mengadsorpsi ion positif sehingga bermuatan positif dan sol As2S3
mengadsorpsi ion negatif sehingga bermuatan negatif. Pemanfaatan sifat
adsorpsi koloid dalam kehidupan antara lain dalam proses pemutihan gula
tebu, dalam pembuatan norit (tablet yang terbuat dari karbon aktif) dan
dalam proses penjernihan air dengan penambahan tawas.
d. Koagulasi Koloid
Koagulasi adalah peristiwa pengendapan
atau penggumpalan koloid. Koloid distabilkan oleh muatannya. Jika muatan
koloid dilucuti atau dihilangkan, maka kestabilannya akan berkurang
sehingga dapat menyebabkan koagulasi atau penggumpalan. Pelucutan muatan
koloid dapat terjadi pada sel elektroforesis atau jika elektrolit
ditambahakan ke dalam system koloid. Apabila arus listrik dialirkan
cukup lama kedalam sel elektroforesis, maka partikel koloid akan
digumpalkan ketika mencapai electrode. Koagulasi koloid karena
penambahan elektrolit terjadi karena koloid bermuatan positif menarik
ion negative dan koloid bermuatan negative menarik ion positif. Ion-ion
tersebut akan membentuk selubung lapisan kedua. Jika selubung itu
terlalu dekat, maka selubung itu akan menetralkan koloid sehingga
terjadi koagulasi.
Animasi koagulasi https://www.youtube.com/watch?v=J44wh7muLC4
Beberapa contoh peristiwa koagulasi dalam kehidupan sehari-hari adalah:
1. Pembentukan delta di muara
sungai karena koloid tanah liat dalam air sungai mengalami koagulasi
ketika
bercampur dengan elektrolit dalam air laut.
2. Karet dalam latek digumpalkan dengan menambahkan asam formiat
3. Lumpur koloidal dalam air sungai dapat digumpalkan dengan menambahkan tawas
4. Asap atau debu pabrik dapat digumpalkan dengan alat koagulasi listrik dari cottrel.
f. Koloid pelindung
Contoh pemanfaatan koloid pelindung adalah sebagai berikut:
Ada koloid yang bersifat melindungi koloid lain supaya tidak mengalami koagulasi. Koloid semacam
ini disebut koloid pelindung. Koloid pelindung ini membentuk lapisan di
sekeliling partikel koloid yang lain sehingga melindungi muatan koloid
tersebut. Koloid pelindung ini akan membungkus partikel zat terdispersi,
sehingga tidak dapat lagi mengelompok.
- Pada pembuatan es krim digunakan gelatin untuk mencegah pembentukan Kristal besar atau gula
- Cat dan tinta dapat bertahan lama karena menggunakan suatu koloid pelindung.
- Zat-zat pengemulsi seperti sabun dan detergen juga tergolong koloid pelindung.
g. Dialisis
Untuk stabilitas koloid diperlukan sejumlah muatanion suatu
elektrolit. Akan tetapi, jika penambahan elektrolit ke dalam sistem
koloid terlalu banyak, kelebihan ini dapat mengendapkan fase terdispersi
dari koloid itu. Hal ini akan mengganggu stabilitas sistem koloid
tersebut. Untuk mencegah kelebihan elektrolit, penambahan elektrolit
dilakukan dengan cara dialisis.

Dialisis merupakan proses pemurnian koloid dengan membersihkan atau
menghilangkan ion-ion pengganggu menggunakan suatu kantong yang terbuat
dari selaput semipermiabel. Caranya, sistem koloid dimasukkan ke dalam
kantong semipermeabel, dan diletakkan dalam air. Selaput semipermeabel
ini hanya dapat dilalui oleh ion-ion, sedang partikel koloid tidak dapat
melaluinya, dengan demikian akan diperoleh koloid yang murni. Ion-ion
yang keluar melalui selaput semipermeabel ini kemudian larut dalam air.
Dalam proses dialisis hilangnya ion-ion dari sistem koloid dapat
dipercepat dengan menggunakan air yang mengalir. Peristiwa dialisis ini
diaplikasikan dalam proses pencucian darah di dunia kedokteran.
Partikel koloid dapat bergerak dalam
medan listrik karena partikel koloid bermuatan listrik. Pergerakan
partikel koloid dalam medan listrik ini disebut elektroforesis. Jika dua
batang elektrode dimasukkan kedalam sistem koloid dan kemudian
dihubungkan dengan sumber arus searah, maka partikel koloid akan
bergerak kesalah satu elektrode tergantung pada jenis muatannya. Koloid
bermuatan negatif akan bergerak ke anode (elektrode positif) sedang
koloid bermuatan positif akan bergerak ke katode (elektrode negatif).
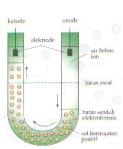 Elektroforesis
dapat digunakan untuk mendeteksi muatan partikel koloid. Jika partikel
koloid berkumpul dielektrode positif berarti koloid bermuatan negatif,
jika partikel koloid berkumpul dielektrode negatif bearti koloid
bermuatan positif. Peristiwa elektroforesis ini sering dimanfaatkan
kepolisian dalam identifikasi/tes DNA pada jenazah korban pembunuhan/
jenazah tak dikenal.
Elektroforesis
dapat digunakan untuk mendeteksi muatan partikel koloid. Jika partikel
koloid berkumpul dielektrode positif berarti koloid bermuatan negatif,
jika partikel koloid berkumpul dielektrode negatif bearti koloid
bermuatan positif. Peristiwa elektroforesis ini sering dimanfaatkan
kepolisian dalam identifikasi/tes DNA pada jenazah korban pembunuhan/
jenazah tak dikenal.Koloid Liofil dan Liofob
Koloid liofol dan koloid liofob umumnya terjadi pada sol, dimana fase terdispersinya padatan dan mediumnya cairan sehingga lebih dikenal dengan sebutan sol liofil dan sol liofob.Sol liofil adalah dimana fase terdispersinya (padatan) senang akan medium pendispersinya (cairan) atau dapat dikatakan bahwa zat terdispersi mempunyai afinitas (daya tarik) yang besar terhadap medium pendispersinya.
Contoh Sol liofil: sabun, detergen, agar-agar, kanji, dan gelatin.
Sol liofob merupakan kebalikan dari sol liofil, yaitu sol dimana fase terdispersinya (padatan) kurang senang akan medium pendispersinya (cairan) atau dapat dikatakan bahwa zat terdispersi mempunyai afinitas (daya tarik) yang kecil terhadap medium pendispersinya.
Contoh Sol liofob: sol belerang, sol Fe(OH)3, sol-sol sulfida, dan sol-sol logam.
Koloid liofil/hidrofil lebih mantap dan lebih kental daripada koloid liofob/ hidrofob. Butir-butir koloid liofil/hidrofil membungkus diri dengan cairan/air mediumnya. Hal ini disebut solvatasi/hidratasi. Dengan cara itu butir-butir koloid tersebut terhindar dari agregasi (pengelompokan). Hal demikian tidak terjadi pada koloid liofob/hidrofob.
Koloid liofob/hidrofob mendapat kestabilan karena mengadsorpsi ion atau muatan listrik. Sebagaimana telah dijelaskan bahwa muatan koloid menstabilkan sistem koloid.
Sol hidrofil tidak akan menggumpal pada penambahan sedikit elektrolit. Zat terdispersi dari sol hidrofil dapat dipisahkan dengan pengendapan atau penguapan. Apabila zat padat tersebut dicampurkan kembali dengan air, maka dapat membentuk kembali sol hidrofil. Dengan perkataan lain, sol hidrofil bersifat reversibel. Sebaliknya, sol hidrofob dapat mengalami koagulasi pada penambahan sedikit elektrolit. Sekali zat terdispersi telah dipisahkan, tidak akan membentuk sol lagi jika dicampur kembali dengan air. Perbedaan sol hidrofil dengan sol hidrofob disimpulkan sebagai berikut:
|
Koloid
liofil
|
Koloid
liofob
|
|
1. Stabil
pada saat yang terdispersi mempunyai konsentrasi kecil maupun besar.
2. Koagulasi
terjadi bila zat elektrolit yang ditambahkan dalam jumlah banyak.
3. Ketika
berkoagulasi berbentuk gumpalan seperti gel.
4. Reversible,
bila dikeringkan dapat membentuk koloid kembali dengan penambahan pendispersi
seperti semula.
5. Kesetabilan
tidak terpengaruh dialisis.
6. Peristiwa
efek Tyndall tidak terlihat jelas
7. Viskositas
besar pada pendispersi murni, bila lama didiamkan akan menyerupai agar-agar.
8. Tekanan
permukaan pendispersi terpengaruh partikel terdispersi.
|
1.
Stabil hanya bila zat yang terdispersi
mempunyai konsentrasi kecil.
2.
Mudah berkoagulasi (mengendap) dalam zat
elektrolit.
3.
Ketika berkoagulasi bentuk gumpalan seperti mayonnaise.
4.
Tidak reversible, bila dikeringkan tidak dapat
membentuk koloid kembali.
5.
Kesetabilan terpengaruh oleh dialisis.
6.
Peristiwa efek Tyndall terlihat jelas.
7.
Viskositas kecil.
8.
Tekanan permukaan pendispersi tidak
terpengaruh partikel terdispersi.
|


0 komentar:
Posting Komentar